 Минздрав выдал разрешение на обращение в условиях пандемии препарату бамланивимаб компании Eli Lilly, обратил внимание «ФВ». Ранее препарат получал разрешение на применение при COVID-19 в составе коктейля антител в США.
Минздрав выдал разрешение на обращение в условиях пандемии препарату бамланивимаб компании Eli Lilly, обратил внимание «ФВ». Ранее препарат получал разрешение на применение при COVID-19 в составе коктейля антител в США.
Минздрав вынес решение на обращение в условиях пандемии бамланивимаба, обратил внимание «ФВ». Решение вынесено регулятором 7 апреля 2021 года. В качестве заявителя в реестре указана компания «Лилли Фарма» (Eli Lilly).
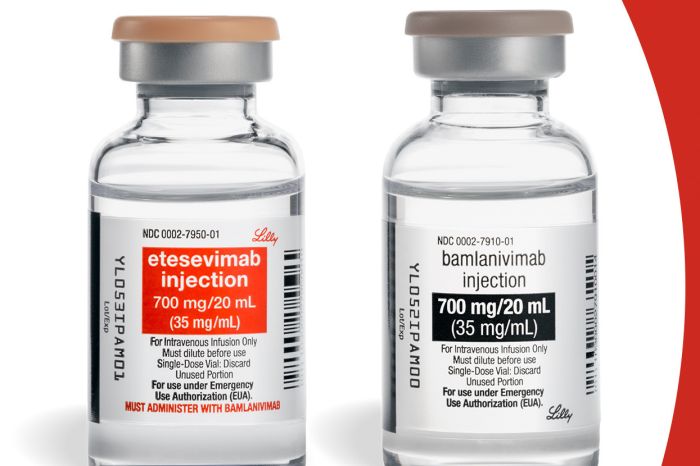
Бамланивимаб — моноклональное антитело, нацеленное на S-белок коронавируса. Лекарство в составе коктейля препаратов bamlanivimab и etesevimab исследовали при COVID-19. Клинические испытания эффективности и безопасности проходили в США. В реестре клинических исследований Минздрава отсутствует запись о разрешении испытания бамланивимаба в России. В действующую десятую версию рекомендаций Минздрава по лечению COVID-19 бамланивимаб не включен. «ФВ» направил запрос в министрество.
Решение об обращении в условиях пандемии выдается на основании Постановления 441 от 3 апреля 2020 года. Оно разрешает особый порядок обращения лекарств для лечения и профилактики заболеваний, которые представляют опасность для окружающих. В условиях чрезвычайной ситуации допускается временное обращение лекарств, не зарегистрированных в России.
Бамланивимаб получил в феврале 2021 разрешение на экстренное применение при COVID-19 в США. Об этом писал ранее «ФВ». Разрешение распространялось на два препарата компании Eli Lilly: bamlanivimab и etesevimab. Применение антител ограничивалось легкой и среднетяжелой формой заболевания с высоким риском развития тяжелых форм, однако включало детей от 12 лет и взрослых.
Уже в апреле FDA отзывает разрешение на применение бамланивимаба отдельно от etesevimab, указывая на «устойчивое увеличение количества вариантов вируса SARS-CoV-2, устойчивых к одному бамланивимабу».
Елена Воронина
pharmvestnik


